���[���@

|
�A�D���͂̈Ӌ` �l�Ԃ́C������P�O���̐H��(NaCl)��K�v�Ƃ��C�����Ɋ���A�ƂȂ��Ă��ꂾ���� �������C�I�����r������܂��B�܂��C���w�H��ł͑��ʂ̐H����p���Ď��̉��w ��i�����C���ꂪ���̎Y�ƂŎg�p����C���ǍH��r���ƂȂ��Ĕr�o����܂��B �C�D���� ���������Ɏ_��n�t�œK�肷��ƁC�������C�I���͋�C�I���Ɣ������ĉ�����̔� �F���a���܂��B�I�_�̔���ɂ́C�N�����_�J���E����Y�����Ă����C �ߏ�̋� �C�I�����Ԃ����F�̃N�����_��̒��a�����邱�Ƃ𗘗p���܂��B �b���|�{�`���{ �� �`���b�� �@�@�@�@�@�@�@�@�@�@ �b���n4�Q�|�{2�`���{ �� �`���Q�b���n�S�@�@�@�@�@�@�@�@ �E�D���� �E0.0282N�����i�g���E���i�m���b���j�W���n�t �E0.0282N�Ɏ_��K��t�@�@�@�@�@�@�@�@�@�@�@ �@�Ɏ_��R�D�S������M�V���ɂƂ�C�����P�O�O�����ɗn�����C���F�r�ɕۑ�����B �E5���N�����_�J���E���w���� �G�D���� ���D�������Q�O�������s�y�b�g�łƂ�C�O�p�t���X�R�̒��ɓ����B ���D�N�����_�J���E���P�������s�y�b�g�łƂ�C�O�p�t���X�R�̒��ɓ����B ���D�Ɏ_��n�t���r�����b�g�ň�H������Ă�����x�F���������߂�B ���D�̂��Ă������łP�D�Q�D�R�D�̑�����s���C�R�łł����������Ɠ����F�ɂ��� ���D���F�Ɏg�p�����Ɏ_��K��t�̗ʂ𑪒肷��B �I�D�v�Z �@C���|ml�^�����R�T�D�S�T�~���`���m�n�R�~�i���|���j �@�����O�D�O�Q�W�Q�m�Ɏ_��K��t�̗͉��@�@�@�@�@�@ �@�����K��l�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �@�����������ł̃u�����N �@�@�@�@�@�@�@�@�@�@�@�@�@ �l�������@�͔�r�I���Z�x��C���|�𑪒肷����@�ł��B�����ł́A�u�P�Oppm�ȉ��̒l �ɂȂ�Ƒ����̃o���c�L�Ό�����v�Ə�����Ă��܂����B�������ǂ��Ȃ�C���|�� �Z�x���Ⴂ�͐������܂����A���B���w���ł͑���̂��D�ɒ��ӂ��Ȃ����y�Ɠ��� �l�������@�ő��肵�Ă��܂��B ���l�������@�̐��x�� �@���x���m�F���邽�߁A20�C10�C5 ppm�̉����i�g���E�����n�t�����A�l������ �@�łQ�肵�܂����B 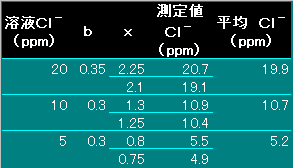 �@�H��l��0.05ml�̌덷�������A�o���c�L�͂�����̂́A�قڋ߂��l�������܂����B �i���{���͉��w��k�C���x���@���̕��́|��S�Ł|�@���w���l�j |
