![]() 惗暔幚尡幒6.
惗暔幚尡幒6.
戜強偱傕偱偒傞俢俶俙拪弌幚尡偱偡
| 2001擭4寧14擔丄崙棫堚揱妛尋媶強乮惷壀導嶰搰巗乯偺堦斒岞奐偱乽偍庤寉丄娙扨幚尡島嵗乿偲偄偆偺傪傗偭偰偄傑偟偨丅乽徚旓惻崬傒966墌偱偁側偨傕俢俶俙傪尒偰傒傑偣傫偐乿偲偄偆幚尡偱偟偨丅夛応偵峴偭偨偲偒偵偼婛偵幚尡偼廔傢偭偰偄傑偟偨偑丄偦偙偵彂偐傟偰偁偭偨曽朄傪尒傞偲戜強偱傕偱偒偦偆偱偟偨丅偦偙偱丄偦偺懠偺帒椏傕嶲峫偵偟偰戜強偱帋傒丄栻昳椶傗曽朄傪岺晇偟偰傒傑偟偨丅埲壓偵偦傟傪帵偟傑偡丅 |
| 嘥丏俢俶俙傪庢傝弌偡 |
亙梡堄偡傞傕偺亜
丒嵽椏亅擺摛
丒婍嬶亅僈儔僗僐僢僾枖偼僈儔僗傃傫2屄丄妱傝偽偟丄拑崡偟
丒栻昳椶亅怘墫悈乮怘墫18倗傪悈偵梟偐偟偰150ml偵偡傞丅偙傟偼栺2mol/l偺擹搙乯丄徚撆梡傾儖僐乕儖丄
僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻乮庡惉暘偼僞儞僷僋暘夝峺慺亅儊僯僐儞姅幃夛幮敪攧偺傾僀僱僗僞僽儗僢僩傪巊梡乯
亙曽朄亜
侾丏傑偢弨旛
徚撆梡傾儖僐乕儖傪椻憼屔傑偨偼椻搥屔偱椻傗偟偰偍偔乮椻搥屔偵擖傟偰傕搥傜側偄乯丅怘墫悈傕椻憼屔偱椻傗偟偰偍偔丅
俀丏僒儞僾儖傪悈偵梟偐偡
僐僢僾乮枖偼僈儔僗傃傫乯偵5ml偺悈傪擖傟傞丅擺摛偺偹偽偹偽傪妱傝偽偟偱姫偒庢傝僐僢僾偺拞偺悈偵梟偐偡丅偙傟傪4乣6夞孞傝曉偡丅偹偽偹偽偺偐偨傑傝偑偁傟偽丄妱傝偽偟偱僐僢僾偺暻偵偙偡傝偮偗偰傎偖偟梟偐偡丅偦偺偁偲拑崡偟偱崡偟偰丄梟偗側偐偭偨偹偽偹偽偺偐偨傑傝傗戝摛曅傪庢傝彍偒丄嬒堦側梟塼偵偡傞乮壓偺幨恀1乯丅
俁丏僒儞僾儖拞偺僞儞僷僋幙傪暘夝偡傞
僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻傪僐僢僾偵侾忶擖傟傞丅帪乆丄僐僢僾傪帩偪忋偘偢偵梙偡傞偲丄僞儞僷僋彍嫀嵻偼10暘傎偳偱梟偗偒傞丅偦偺屻丄僞儞僷僋彍嫀嵻偺巊梡愢柧彂偵彂偄偰偁傞帪娫偩偗偦偺傑傑偵偟偰偍偔乮傾僀僱僗僞僽儗僢僩偺応崌偼4帪娫乯丅
係丏俢俶俙傪拪弌偡傞
帪娫偵側偭偨傜丄俁丏偺僐僢僾傪昘悈偵偮偗偰椻傗偡丅偦偺僐僢僾偵丄椻傗偟偨怘墫悈5ml傪壛偊偰崿偤傞
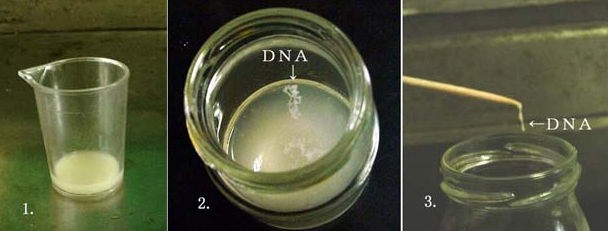
俆丏俢俶俙傪庢傝弌偡
暿偺僐僢僾偵丄椻傗偟偨徚撆梡傾儖僐乕儖30ml傪擖傟傞丅偙偺僐僢僾偵擺摛傪梟偐偟偨悈乮係丏偺僐僢僾偺拞恎乯傪彮検惷偐偵拲偖丅徚撆梡傾儖僐乕儖傪擖傟偨僐僢僾傪帩偪忋偘偢偵丄備偭偔傝惷偐偵梙傜偡丅偡傞偲傾儖僐乕儖拞偵巺偔偢偺傛偆側傕偺偑尒偊偰偔傞丅偙傟偑俢俶俙偱偁傞丅懕偄偰傑偨擺摛傪梟偐偟偨悈傪彮検偯偮徚撆梡傾儖僐乕儖偵拲偄偱偐傜丄僐僢僾傪備偭偔傝惷偐偵梙傜偡偙偲傪孞傝曉偡丅巺偔偢忬偺俢俶俙偼偝傜偵憹偊傞丅偦偺傑傑惷抲偟偰偍偔偲巺偔偢忬偺俢俶俙偼悈柺傑偱晜偒忋偑偭偰偔傞乮幨恀俀乯丅幨恀俁偼丄偙偺俢俶俙傪抾孁偵偮偗偰堷偒忋偘偨偲偙傠丅偙偺偲偒塼拞偵偼敀偄捑揳偑堦柺偵傂傠偑偭偰偄傞偑丄師戞偵掙偵捑傫偱偄偔丅
| 嘦丏俢俶俙偱偁傞偙偲偺妋擣 |
拪弌偟偨巺偔偢忬偺傕偺偑俢俶俙偱偁傞偙偲偺妋擣幚尡丅巺偔偢忬偺傕偺偺梟塼傪傠巻偵僾儘僢僩偟偦傟傪丄恷巁僇乕儈儞丄儊僠儗儞僽儖乕乮偄偢傟傕嵶朎偺尠旝嬀娤嶡偺嵺偵妀傪愼怓偡傞怓慺乯偺梟塼偵怹偡丅俢俶俙偱偁傟偽愼怓偝傟傞偼偢偱偁傞丅
亙梡堄偡傞傕偺亜
丒嵽椏亅忋婰嘥丏偺幚尡偱拪弌偟偨巺偔偢忬偺傕偺
丒婍嬶亅傠巻乮揤傉傜晘偒巻丄僐乕僸乕僼傿儖僞乕側偳偱傕壜乯丄僗儔僀僪僈儔僗丄抾孁丄僈儔僗朹乮傑偨偼妱傝偽偟乯丄僗億僀僩
丒栻昳椶亅恷巁僇乕儈儞丄儊僠儗儞僽儖乕
亙曽朄亜
侾丏傾儖僐乕儖傪彍偔
抾孁偱丄拪弌偟偨巺偔偢忬偺傕偺傪僑儅3棻暘偔傜偄偺検偲傞丅傠巻偵寉偔怗傟偝偣偰傾儖僐乕儖傪彍偔丅偙偺偲偒傠巻偵嫮偔墴偟晅偗傞偲傌偨偭偲偔偭偮偄偰偟傑偆偺偱梫拲堄丅
俀丏擹偄梟塼傪偮偔傞
巺偔偢忬偺傕偺傪偦偺傑傑僗儔僀僪僈儔僗偵忔偣丄偦偙偵僗億僀僩偱悈傪侾揌偨傜偡丅僈儔僗朹偐抾孁偱偹傞傛偆偵偟偰偙偺悈偵梟偐偡丅梟偗偨晹暘偼摟柧偵側傞丅悈偑晄懌側傜偽彮検曗偭偰偝傜偵梟偐偡丅
俁丏傠巻偵僾儘僢僩偡傞
偙偺梟塼傪僈儔僗朹偐妱傝偽偟側偳偱丄傠巻偵偸傝偮偗傞丅
斾妑偺偨傔丄拪弌塼乮嘥丏偺係丏抜奒偺塼丅偡側傢偪徚撆梡傾儖僐乕儖偵拲偖慜偺塼乯偲捑揳乮巺偔偢忬偺傕偺偑晜偐傃忋偑偭偨偲偒丄傃傫偺掙偵捑傫偱偄傞傕偺乯傕摨偠傠巻偵僾儘僢僩偟偨丅捑揳偼傗偼傝彮検偺悈偵梟偐偟偰僾儘僢僩偟偨丅
埲忋偺傛偆偵僒儞僾儖傪偮偗偨傠巻傪丄俀枃嶌傞丅
係丏怓慺梟塼偵怹偡
僒儞僾儖傪偮偗偨傠巻偺偆偪侾枃偼恷巁僇乕儈儞偵丄傕偆侾枃偼儊僠儗儞僽儖乕偵怹偟丄偄偢傟傕俆暘偍偔丅偦偺屻擬搾偱愻偆丅
亙寢壥亜
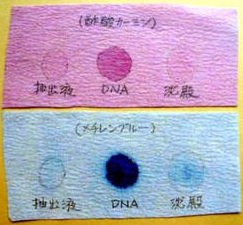
嵍偺幨恀偺傛偆偵側偭偨丅忋偺傠巻偑恷巁僇乕儈儞丄壓偑儊僠儗儞僽儖乕偵怹偟偨傕偺丅
墧昅彂偒偺椫妔偼丄帒椏傪僾儘僢僩偟偨嵺偵僗億僢僩偑峀偑偭偨斖埻丅拞墰偺僗億僢僩偑巺偔偢忬偺傕偺偺悈梟塼丅嵍抂偺僗億僢僩偼拪弌塼丄塃抂偺偼捑揳乮忋婰亙曽朄亜俁丏嶲徠乯丅
恷巁僇乕儈儞丄儊僠儗儞僽儖乕偲傕偵巺偔偢忬偺傕偺偺悈梟塼偺僗億僢僩偼擹偔愼怓偝傟偨丅
拪弌塼丄捑揳偺僗億僢僩傕敄偔愼怓偝傟偰偄傞丅拪弌塼偵偼俢俶俙偑敄偔梟偗偨忬懺丄傑偨捑揳偵偼俢俶俙偑傑偩偄偔傜偐娷傑傟偰偄傞偨傔偲峫偊傜傟傞丅
| 嘨丏曽朄偺僶儕僄乕僔儑儞 |
侾丏僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻偺懼傢傝偵
嘆 僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻傪壛偊偢偵丄乮偦偺懠偺偙偲偼嘥丏偺夁掱偳偍傝偵乯幚尡偟偰傒偨丅
巺偔偢忬偺俢俶俙偼尰傟偨偑僞儞僷僋彍嫀嵻傪巊偭偨応崌偵斾傋丄検偼偢偭偲彮側偐偭偨丅偟偐偟丄俢俶俙傪尒傞偲偄偆偩偗側傜偙傟偱傕傛偄丅
嘇僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻偺懼傢傝偵丄僷僀僫僢僾儖丄僉僂僀乮偄偢傟傕僞儞僷僋暘夝峺慺傪娷傓乯偺廯傪巊偭偰偦傟偧傟3夞偢偮幚尡偟偰傒偨丅
僷僀僫僢僾儖偺応崌偼2夞偼俢俶俙偼彮偟尰傟偨偺偑擣傔傜傟偨偑丄偁偲1夞偼擣傔傜傟側偐偭偨丅傑偨丄僉僂僀偱偼3夞偲傕俢俶俙偼尰傟側偐偭偨丅
壥暔偺僞儞僷僋暘夝峺慺偺岠壥偺掱搙偼丄偦偺壥暔偺惗棟揑忬懺偵傛傞傕偺偐傕偟傟側偄丅偄偢傟偵偟傠丄妋幚偵俢俶俙傪庢傝弌偡偨傔偵偼丄偙傟傜偺壥暔偺廯傛傝偼丄傗偼傝僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻傪巊偭偨曽偑傛偄偲尵偊傞丅
俀丏僞儞僷僋彍嫀嵻傪嶌梡偝偣傞帪娫傪抁弅偡傞偲
僐儞僞僋僩儗儞僘梡僞儞僷僋彍嫀嵻傪梟偐偟偰偐傜偦偺傑傑偵偟偰偍偔帪娫傪乮4帪娫偱偼側偔乯偢偭偲抁弅偟偰30暘偵偟偰傒偨丅4帪娫偍偄偨応崌偵斾傋検偼偢偭偲彮側偄偑丄巺偔偢忬偺俢俶俙偼尰傟偨丅俢俶俙傪尒傞偲偄偆偩偗側傜偙偺掱搙偺帪娫偱傕傛偄丅
| 嘩丏屻婰 |
丒偙偺曽朄偼丄擺摛偲偄偆庤嬤偐側嵽椏傪巊偄丄摿庩側栻昳傗墦怱暘棧婡婍側偳偺婍嬶傪梡偄側偄偲偄偆偙偲偱乽戜強偱傕偱偒傞俢俶俙偺拪弌朄乿偱偡丅偟偐偟丄庢傝弌偣傞俢俶俙偺検偼彮側偔丄傑偨晄弮暔傕懡偔娷傑傟偰偄傞偲巚傢傟傑偡丅偨偩俢俶俙傪尒傞偲偄偆偙偲側傜偙傟偱廩暘偱偟傚偆丅
丒乽嘦丏俢俶俙偱偁傞偙偲偺妋擣乿偵偮偄偰
偙偺幚尡偼戜強偵偁傞傕偺偩偗偱偼偱偒傑偣傫偑丅崅峑偺惗暔偺庼嬈偱偺惗搆幚尡偵偼丄傑偢尠旝嬀偱偺嵶朎娤嶡偱恷巁僇乕儈儞丄儊僠儗儞僽儖乕偱妀偑愼傑傞偺傪娤嶡偟偰偐傜丄偙偺幚尡傪峴偊偽棟夝偵桳岠偩偲巚偄傑偡丅偟偐偟丄尩枾偵俢俶俙傪摨掕偡傞偵偼尋媶幒儗儀儖偺幚尡偑昁梫側偲偙傠偱偟傚偆丅
乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧乧
亙嶲峫帒椏亜
侾乯2001擭4寧14擔丄崙棫堚揱妛尋媶強乮惷壀導嶰搰巗乯偺堦斒岞奐偱偺乽偍庤寉丄娙扨幚尡島嵗乿亅乽偙傟偼撊栘偺崅峑偺愭惗乮幁徖崅峑丄嵵摗棽抝乯偑崙棫攷暔娰僯儏乕僗偵搳峞偝傟偨傕偺傪堷梡偟偨傕偺偱偡乿偲彂偐傟偰偁偭偨丅
俀乯Web僒僀僩亅俢俶俙拪弌幚尡乮http://village.infoweb.ne.jp/~yasuhisa/DNAext.htm乯怷揷曐媣丒嶌惉
俁乯Web僒僀僩亅俢俶俙妋擣幚尡乮http://village.infoweb.ne.jp/~yasuhisa/DNAex們.htm乯怷揷曐媣丒嶌惉
係乯Web僒僀僩亅戜強偱偱偒傞俢俶俙拪弌乮http://village.infoweb.ne.jp/~yasuhisa/ktinDNA.htm乯怷揷曐媣丒嶌惉
俆乯暯惉7擭搙惷壀戝妛棟妛晹壔妛岞奐島嵗僥僉僗僩乮惷壀戝妛棟妛晹壔妛壢乯
俇乯曻憲戝妛報嶞嫵嵽 暘巕惗暔妛乮曻憲戝妛嫵堢怳嫽夛乯 嶰塝嬣堦榊丒曇挊
| 師傊 | 栠傞 |
| 惗暔幚尡幒栚師傊 | 俿倧倫偺儁乕僕僿 |